|
Atomen
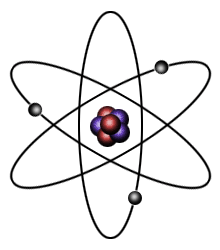
When the a planet moves around the sun, you can plot a definite path for it which is called an orbit. A simple view of the atom looks similar and you may have pictured the electrons as orbiting around the nucleus. The truth is different, and electrons in fact inhabit regions of space known as orbitals. Jim Clark Redan 1904 lade Hantaro Nagaoka fram en s.k. "saturnisk" (saturnian eller planetary) modell där elektronerna bildade ringar runt atomkärnan, ringar som var stabila på ungefär samma sätt som Saturnus ringar är stabila. Ju mer energi en elektron hade, desto avlägsnare bana fick den. Ett problem med modellen är att elektronen enligt klassisk fysik borde utstråla energi på sin färd, och därmed cirkla allt närmare kärnan, för att rätt strax krascha in i den. Rutherford vidareutvecklade Nagaokas modell - och skapade i princip den bild av atomen som sedan dess (1911) varit den mest använda. Även om denna modell förklarade flera egenskaper så återstod problemet med elektronernas banor. 1913 "löste" Niels Bohr problemet genom att helt enkelt konstatera att så länge en elektron är i en "tillåten" bana, kallad elektronskal eller orbital, så avger den ingen strålning. När den absolut vill avge strålning så byter den ögonblickligen till en lägre bana, liksom den byter till en högre bana om den upptar energi (härav uttrycket kvantsprång, quantum leap, ofta använt om stora språng vilket alltså sannerligen inte är korrekt - det som ursprungligen avsågs var plötsliga språng). Någon motivering till detta kunde han dock inte ge. As Bohr fully realised, this model is largely ad hoc, if not downright ugly. It does, however, "explain" the line spectra of the elements. David M. Harrison Med alla sina brister (en annan var att den i princip enbart arbetade med den allra enklaste atomen, väte) var modellen ändå det bästa världen dittills sett, och avgjort värd det nobelpris den genererade. Den lärs också fortfarande ut, eftersom den är såpass användbar inom t.ex. kemin. Att inte krångla till saker i onödan är en god princip, och man kommer mycket långt med elektronskals-atomen (liksom man inom fysiken klarar sig rätt långt med Newtons teorier, utan att behöva ta till relativitetsteori eller kvantmekanik). Men som slutgiltig beskrivning av verkligheten lämnar den icke desto mindre en del att önska. 1905 visade Einstein att ljus inte bara är vågor utan även partiklar, fotoner - och det samtidigt. 1924 föreslog de Broglie att all materia inte bara är partiklar, utan även vågor - och det samtidigt. För vardagsfysiken spelar detta ingen roll (i synnerhet som det just inte går att föreställa sig), men för atommodellen gör det all skillnad i världen. 1926 utvecklade Schrödinger (han med katten) en atommodell där elektronerna beskrivs som vågor. (Not: Eftersom neutronens existens inte slogs fast förrän 1932 så är den välkända bild som inleder denna artikel på sätt och vis en anakronism.)
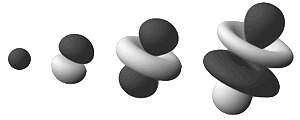
Although this model was difficult to visually conceptualize, it was able to explain many observations of atomic behavior that previous models could not, such as certain structural and spectral patterns of atoms bigger than hydrogen. Thus, the planetary model of the atom was discarded in favor of one that described orbital zones around the nucleus where a given electron is most likely to exist. Wikipedia "Difficult to visually conceptualize" är just ingen underdrift. Elektronerna utgörs av stående sannolikhetsvågor, som anger sannolikheten för att observera resp. elektron på en viss plats. Dessa orbitaler kan bilda helt andra former kring kärnan än de traditionella "planetära" lök-skalen. Elektronerna beskriver heller inte jämna fina banor utan kan hoppa omkring precis som de vill, så länge de följer kvantmekanikens statistiska lagar. (De avbildade ytorna är i princip godtyckliga, man kan ange de områden där resp. elektron har, säg, 95 % sannolikhet att visa sig. En orbital på 100 % är lika stor som universum.) Eftersom en atom är tredimensionell visar det sig att det behövs tre kvanttal för att beskriva varje kvanttillstånd för atomen (egentligen fyra, det finns ytterligare ett som är kopplat till elektronens spinn). Det första är huvudkvanttalet, n, som vi känner till sedan tidigare och ingår i energiekvationen för atomens tillstånd. Det andra kan vi kalla bankvanttalet (orbital quantum number), l, och det säger oss att en elektrons impulsmoment bara kan anta vissa värden. Det tredje kvanttalet, ml (orbital magnetic quantum number), är relaterat till orienteringen av impulsmomentsvektorn. Detta låter möjligen lite kryptiskt och är inte helt lätt att förstå. Dock är det så här man beskriver den moderna atommodellen. Sandström & Johansson Det lär också dröja innan man ersätter den stunsiga "saturniska" modellen med sannolikhetsmoln i logotyperna för exempelvis IAEA eller USA:s energidepartement; eller otaliga forskningsinstitut världen över; för att inte tala om mängder av material för eller emot kärnkraft; och så vidare. Relaterat: Spinn Referenser:
|